RMMG - Revista Médica de Minas Gerais
ISSN (on-line): 2238-3182
ISSN (Impressa): 0103-880X
CAPES/Qualis: B2
Volume: 13. 3
Artigos de Revisão
A lesão cardíaca vorticilar associada à doença de Chagas
The apical lesion of the heart in Chagas' disease
Joana Luíza de Lima Silva1; Mauro Martins Teixeira2; Ênio Roberto Pietra Pedroso3; Manoel Otávio da Costa Rocha4
1. Acadêmica da Faculdade de Medicina da Universidade Federal de Minas Gerais (FM-UFMG)
2. Professor Adjunto, Doutor, Departamento de Bioquímica e Imunologia do Instituto de Ciências Biológicas da UFMG
3. Professor Titular, Departamento de Clínica Médica (FM-UFMG)
4. Professor Adjunto, Doutor, Departamento de Clínica Médica (FM-UFMG)
Joana Luíza de Lima Silva
Rua Dom Lúcio Antunes, 400/1002 - Coração Eucarístico
Belo Horizonte, MG CEP: 30535-630
Tel.: (31)3375-6284
E-mail: jolls@ig.com.br
Faculdade de Medicina da UFMG
Resumo
A doença de Chagas é dentre as miocardiopatias a que apresenta alterações cardíacas apicais com maior freqüência. A lesão vorticilar (LV) prevalece no ventrículo esquerdo, é menos freqüente na fase aguda da moléstia e possui maior incidência no sexo masculino. A sua patogênese é controversa. As várias hipóteses que tentam explicar a gênese da LV se baseiam em fatores inflamatórios e mecânicos, até na possível contribuição de distúrbios de condução e da disautonomia parassimpática.
A LV não se associa a qualquer padrão eletrocardiográfico específico. O método mais fidedigno na sua identificação, apesar de invasivo, parece ser a ventriculografia contrastada.
Esse tipo de lesão cardíaca compromete a função ventricular na dependência do tamanho da área discinética ou acinética. É ainda responsável por eventos arritmogênicos e tromboembólicos. Para o tratamento, considera-se a aneurismectomia apenas em casos selecionados e relacionados à trombose apical como fonte embolígena ou a fator arritmogênico associado à própria lesão.
Palavras-chave: Doença de Chagas; Lesão vorticilar; Patologia
Dentre as cardiopatias conhecidas, nenhuma apresenta alterações apicais com tanta freqüência como a de etiologia chagásica.1
Essas alterações prevalecem no ventrículo esquerdo, embora possam ocorrer também no ventrículo direito, e têm sido nomeadas de maneira diversa: aneurisma ventricular,1 lesão necrótica da ponta do coração,2 lesão apical,3 lesão vorticilar,4 adelgaçamento da ponta,5 fibrose apical,6 pseudoaneurisma do ápex7 e lesão atrófica do vórtex.8 A lesão vorticilar (LV) é menos freqüente na fase aguda da moléstia, assim como nas grandes cardiomegalias da fase crônica; sua incidência é maior nos casos de moderado aumento do coração.1 Possui maior incidência nos homens. É provável que seja favorecida pelo exercício físico.9
PATOGÊNESE
A principal controvérsia sobre a LV é sua patogênese. As várias hipóteses que tentam explicá-la baseiam-se: 1) na miocardite, 2) no fator mecânico, 3) no bloqueio divisional anterior esquerdo, 4) no distúrbio de condução, 5) na disautonomia cardíaca, principalmente parassimpática.
A LV pode ser conseqüência da dilatação global das cavidades cardíacas, secundária à miocardite chagásica crônica.10 A eficiência cardíaca reduz com a dilatação do coração; em conseqüência, aumenta o volume sangüíneo telessistólico. Esse sangue estagnado e a endocardite parietal crônica, resultante de áreas focais de reativação do processo inflamatório, seriam fatores determinantes da trombose, devido à estimulação dos sistemas intrínsecos da coagulação. Instalado o fenômeno inicial, as alterações isquêmicas e inflamatórias, secundárias à presença do trombo, atuariam em conjunto e acarretariam a maior extensão da lesão.10
Noutra linha de pensamento, a LV é considerada como expressão de uma cadeia de eventos, na qual o primeiro deles não seria, necessariamente, o primeiro em importância. Esses fatores, atuando um após o outro, terminariam por proporcionar condições para a formação da lesão. O "fator mecânico" é indispensável na responsabilização da LV.4
Alguns autores tentaram correlacionar a presença da LV com distúrbios cardíacos de condução do estímulo elétrico, como o Bloqueio Divisional Anterior Esquerdo (BDAE).6 Para esses autores, haveria, primeiro, um comprometimento variável da musculatura cardíaca pelos processos inflamatórios, incluindo a ponta do coração. Esses processos culminariam na lesão do sistema de condução, particularmente do fascículo anterior do ramo esquerdo do feixe de His, determinando atraso na estimulogênese elétrica das regiões justa-septal e apical. Esse atraso na contração da musculatura propiciaria diminuição da resistência à ação de pressões sistólicas e, conseqüentemente, hiperdistensibilidade, especialmente em uma área cuja parede já é mais delgada, por constituição anatômica. Os estádios posteriores seriam a ruptura de fibras miocárdicas da área distendida, o espessamento subendocárdico por estímulo mecânico, a fibrose regional secundária às lesões chagásicas e a anoxia focal, resultante do estiramento regional da rede capilar. Essa seqüência de eventos produziria a dilatação progressiva da ponta, formando o verdadeiro aneurisma.6 Em estudo envolvendo 34 cardiopatas chagásicos crônicos, não foi encontrada diferença estatisticamente significativa entre as freqüências de lesão vorticilar esquerda nos chagásicos com e sem BDAE.2 Existem casos de BDAE sem LV e de LV sem a presença de transtorno de condução.1,5 Este achado é explicado pelo fato de a área da ponta ter como via de ativação um ramo intermediário, ou fascículo médio do ramo esquerdo, e não o fascículo anterior.1
Alguns estudos sugerem que o assincronismo regional acarretado pelos distúrbios de condução nos fascículos ou na rede de Purkinje possa ter papel relevante no determinismo da LV.1,3
Bittencourt et al.6 cogitaram sobre a importância do comprometimento do sistema nervoso vegetativo, particularmente o parassimpático, na determinação da lesão apical. Ao interferir na freqüência cardíaca e também sobre o tônus e a força contrátil do miocárdio, aumentando a força da musculatura cardíaca na base, sem aumentá-la proporcionalmente no ápice, o transtorno neurovegetativo seria mais um fator a propiciar o surgimento da LV no chagásico.6
Outro estudo correlacionou a LV com a diminuição das células nervosas, principalmente as parassimpáticas, com microinfartos e miocitólise focal, além da destruição de células musculares.9
Granzotti et al.5, estudando 15 chagásicos, com o propósito fundamental de determinar a integridade ou não do sistema nervoso autônomo do coração nos doentes nos quais pudesse ser identificada a LV, observaram três pacientes com evidentes anormalidades parassimpáticas, que não apresentavam imagem radiológica sugestiva de aneurisma de ponta. Ao contrário, seis doentes com LV exibiam atividade parassimpática preservada.5
Com base no exposto, considera-se que a etiopatogênese da LV, embora não inteiramente esclarecida, pareça ser caráter multifatorial. Os mecanismos patogenéticos diversos envolvidos incluem isquemia, inflamação, trombose, fatores mecânicos (alterações essencialmente segmentares),7 espessura afilada da parede apical e, principalmente, alterações da cinética regional do ventrículo esquerdo, relacionadas com a denervação parassimpática ou não.1,3,9
PATOLOGIA
Pensou-se que a LV iniciar-se-ia por trombose mural da zona apical do ventrículo esquerdo, sendo seguida por alterações fibrótico-degenerativas do endocárdio e do miocárdio subjacentes. Essa lesão seria constituída por três zonas distintas: uma, formada pelo trombo parietal (avermelhado e friável), a seguir uma zona de fibrose, esbranquiçada, e por fim uma zona mais externa, representada por uma faixa de miocárdio de aparência normal, de cor acastanhada.8
A localização mais freqüente da LV é no ventrículo esquerdo, local onde ela é também mais característica, com prevalência variável de acordo com os estudos. Esse fato relaciona-se, provavelmente, com a diferente estrutura anatômico-funcional dos dois ventrículos.4
O vórtex é a zona apical cardíaca mais próxima do apex cordis, onde os feixes musculares sino e bulboespirais, que o constituem, se infletem sobre si para seguirem em direção a seu ponto de origem. Isso determinaria o surgimento de área de menor resistência.4,11,12 Nos corações chagásicos com LV esquerda, há, como regra, uma superposição entre o vórtex e o vértice ou apex cordis.4
Para Raso4, a LV se localiza no vórtex, mais precisamente no espaço formado pelo afastamento daqueles dois feixes, que varia de acordo com o tamanho da lesão, sendo discreto e pequeno nas lesões iniciais, e mais extenso nas maiores. Entre os feixes, encontra-se, na maioria dos casos, o endocárdio projetado para fora, à maneira de uma hérnia. O exame morfológico mostra, predominantemente, fibras musculares rotas ou parcialmente destruídas, em correspondência com a lesão. A região da lesão é raramente atravessada por fibras musculares mais alongadas, atingindo a margem oposta.
Verifica-se que há variação substancial de tamanho de caso para caso. A LV pode ser classificada quanto a este aspecto como pequena, quando igual ou menor que 1 cm; média, entre 1 e 3 cm; e grande, se acima de 3 cm.1
O aspecto da lesão é variável quando examinada pela superfície externa, podendo ser representado por uma depressão mais baixa do que o nível dos cornos, estar no mesmo nível ou, ainda, ultrapassá-lo. Isto evidenciaria uma relação direta entre a intensidade do afastamento dos feixes musculares e a forma da lesão - cuia ou vidro de relógio, com a concavidade voltada para o epicárdio, nos casos de pequeno afastamento, ou como uma saliência convexa, nos casos de maior afastamento.4
A morfologia da LV é variada. A lesão apical aneurismática mamilar1 é considerada a forma típica. Pode se apresentar, entretanto, como "dedo de luva", "em raquete" e com outros aspectos5 (Figuras 1 e 2). Há, ainda, formas menos características, como área de espessamento subendocárdico com trombo aderente; dilatação aneurismática em calota ou semilunar e fibrose apical; e ainda área extensa de espessamento subendocárdico sem aneurisma.1 Acredita-se que esta grande variedade morfológica corresponda a distintas fases evolutivas da LV, sob um determinismo dinâmico, peculiar ao tempo de evolução, às condições da parede neste local e à extensão da área acinética.1

Figura 1 - Paciente chagásico. Aneurisma apical visto à ecocardiografia transtorácica
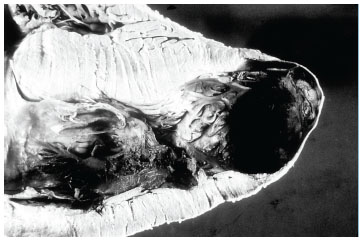
Figura 2 - Aneurisma apical. Cardiopatia chagásica crônica. Departamento de Anatomia Patológica, Faculdade de Medicina, UFMG
De maneira geral, a formação e a evolução da LV parecem depender de duas alterações: afastamento dos dois cornos e coincidência entre o ápice e o vórtex. Assim, o adelgaçamento simples da parede representaria a fase mais inicial da lesão que, com o tempo, poderia adquirir o aspecto de depressão ou de hérnia, dependendo do maior ou menor afastamento dos feixes musculares externos do vórtex.4
ELEMENTOS INDICATIVOS DA LESÃO VORTICILAR
A LV chegou a ser interpretada como determinante de um "padrão eletrocardiográfico descrito como necrose de ponta".4 Foi observado, entretanto, que o padrão considerado sugestivo de LV era encontrado em corações com e sem a lesão. Estes padrões foram especialmente admitidos como indicação de fibrose da parede anterior, independentemente da presença da LV.5
Posteriormente, outro estudo concluiu que o padrão eletrocardiográfico na "necrose de ponta" dependeria do hemibloqueio anterior esquerdo e não da própria LV.5,6
A LV parece não se associar com qualquer padrão eletrocardiográfico específico.8,13 Ela coexistiria com várias alterações encontradas no ECG, sem que se possa destacar a predominância de uma delas.5
Os achados ecocardiográficos revelam comprometimento mais acentuado da dinâmica sistólica da região póstero-inferior do ventrículo esquerdo em relação à do septo inter-ventricular e de sua parede anterior.14,15,16 Isto caracteriza o comprometimento segmentar do miocárdio.15 Torna-se necessário, entretanto, salientar que estes são achados comuns em pacientes chagásicos, de maneira geral, e não só naqueles pacientes com LV.
A ventriculografia contrastada, apesar de ser método invasivo, é o exame mais sensível para identificar a LV.13 Através deste procedimento, pode-se avaliar o tamanho, forma e cinética da LV e detectar a presença de trombos. As anormalidades de contração assumem padrão variado, de acinesia ou discinesia apical, melhor demonstrados na posição oblíqua anterior direita com inclinação de 30 graus.13
IMPORTÂNCIA CLÍNICA E PROGNÓSTICO
A função ventricular se mantém inalterada na presença de pequenas regiões acinéticas ou discinéticas da parede ventricular, já que o volume destas comumente não altera substancialmente o volume ventricular ou modifica, significativamente, a fração de ejeção. Nos casos em que a LV se acompanha de grande área discinética e a função ventricular encontra-se comprometida, a lesão deve ser responsável, pelo menos em parte, pelo comprometimento mecânico.13
Considera-se que o prognóstico de pacientes chagásicos é pior quando há LV,9 o que pode ser explicado pela alta prevalência deste tipo de lesão em pacientes com morte súbita, sem história prévia de doença cardíaca, em decorrência de arritmias e acidentes tromboembólicos.11,13 Daí o interesse em diagnosticar a LV o mais precocemente possível.
TRATAMENTO
A possibilidade de tratamento cirúrgico da LV na Doença de Chagas foi cogitada à semelhança da cardiopatia isquêmica, sendo proposta como terapêutica a ressecção das áreas não-contráteis. Não há, entretanto, indicação cirúrgica para a LV visando melhoria da insuficiência cardíaca.17 Nos casos estudados com este fim, a área de acinesia apical era de pequena dimensão e não constituía fator importante em face da diminuição global da contratilidade miocárdica. A exceção deve ser feita para casos pouco habituais, nos quais a área de acinesia apical é mais extensa.17
A indicação cirúrgica pode ser considerada nos casos de trombose apical que constitua potencial fonte embolígena.13
Sosa et al.18 constataram que, na cardiopatia chagásica crônica, a "origem" da taquicardia ventricular sustentada (TV) nem sempre está relacionada com o local do aneurisma, exceto naqueles inferiores, e que a região ínfero-lateral do ventrículo esquerdo é o local onde com maior freqüência se origina a TV.18
A aneurismectomia convencional, portanto, é opção terapêutica para casos selecionados, isto é, nos quais haja coincidência da LV com o foco arritmogênico.13,18
CONCLUSÃO
A LV é uma das diversas formas de apresentação da mio-cardiopatia chagásica crônica, doença endêmica em nosso meio. Daí o interesse em compreendê-la melhor.
Este tipo de lesão cardíaca parece estar relacionado com eventos arritmogênicos e tromboembólicos, ambos com alta morbimortalidade.
Apesar de sua importância, a LV ainda não está bem definida, seja do ponto de vista da etiopatogenia (multifatorial), das manifestações clínicas (extremamente variadas) ou do tratamento (aneurismectomia).
Novos estudos são necessários para o esclarecimento de questões ainda controversas sobre a LV.
REFERÊNCIAS BIBLIOGRÁFICAS
1- Carvalhal SS, Bittencourt LAK, Nogueira EA, Jorge PAR, Curti HJV, Sanches PCR. A lesão apical na cardiopatia chagásica. Arq Bras Cardiol 1980;35:171-6.
2- Almeida HO, Miziara LJ, Prata SP, Frange PJ, Yamamoto I. Hemibloqueio anterior esquerdo e lesão vorticilar esquerda na cardiopatia chagásica crônica. Arq Bras Cardiol 1975;28:293-8.
3- Almeida EA, Manigot DA, Guariento, ME et al. A lesão apical: aspectos eletrocardiográficos. In: Cançado JR, Chuster M. Cardiopatia chagásica. Belo Horizonte: Fundação Carlos Chagas; 1985.
4- Raso P. Contribuição ao estudo da lesão vorticilar na cardite chagásica crônica. [Tese] Belo Horizonte: Faculdade de Medicina da UFMG; 1964.
5- Granzotti JA. Contribuição ao estudo do aneurisma da ponta na cardiopatia chagásica. Arq Bras Cardiol 1974;27:477-87.
6- Bittencourt LA, Carvalhal S, Jorge PAR, Pires WR, Filho SC. Sobre a patogenia da lesão apical do coração na cardiopatia chagásica. Arq Bras Cardiol 1973;26:577-83.
7- Câmara EJN. Alterações segmentares da contratilidade do ventrículo esquerdo na cardiopatia chagásica com e sem dilatação ventricular. Arq Bras Cardiol 1993;6:151-5.
8- Andrade ZA. Trypanossoma cruzi e Doença de Chagas: patologia da Doença de Chagas. Rio de Janeiro: Guanabara Koogan; 1979.
9- Oliveira JSM, Oliveira JAM, Frederigue V, Filho ECL. Apical aneurysm of Chagas's heart disease. Br Heart J 1981;46:432-7.
10- Andrade ZA. A lesão apical do coração na miocardite crônica chagásica. "O Hospital" 1956;50:59-72.
11- Lopes NMP, Filho JM, Filho JMA, Benchimol CB, Filho JBMG. Correlação entre os achados da ecocardiografia bidimensional e a cineventriculografia esquerda na lesão apical de ventrículo esquerdo na cardiopatia chagásica crônica. Arq Bras Cardiol 1986;46:105-13.
12- Lopes ER, Chapadeiro E, Tafuri WL, Prata AR. Patologia das principais doenças tropicais no Brasil. In: Brasileiro Filho G. Bogliolo Patologia. 5a. ed. Rio de Janeiro: Guanabara Koogan; 1994. p.1141.
13- Nogueira EA, Ueti OM, Vieira WR. A lesão apical da cardiopatia. Rev Soc Cardiol Estado de São Paulo 1994;4:212-22.
14- Ortiz J, Sanagua J, Nero E, Tranchesi J, Macruz R, Pillegi F. Estudo ecocardiográfico da forma crônica da miocardiopatia chagásica. Arq Bras Cardiol 1978;31:1-6.
15- Ortiz J. Aspectos ecocardiográficos. In: Cançado JR, Chuster M. Cardiopatia chagásica. Belo Horizonte: Fundação Carlos Chagas; 1985 p.425.
16- Salomone AO, Caeiro T. Alteraciones regionales de la motilidad ventricular en pacientes com serologia positiva para la enfermedad de Chagas. Medcina (Buenos Aires) 1996;56:690-8.
17- Bittencourt LAK, Carvalhal SS, Júnior AM. Sobre a expressão eletrocardiográfica da lesão apical na cardiopatia chagásica. Arq. Bras. Cardiol 1975;28:437-42.
18- Sosa EA, Scanavacca MI, Marcial MB, Jatene A. Terapêutica não farmacológica das arritmias. In: SOCESP. Cardiologia: Atualização e reciclagem. Rio de Janeiro: Atheneu; 1994. p.699-712.
Copyright 2025 Revista Médica de Minas Gerais

This work is licensed under a Creative Commons Attribution 4.0 International License
